-
溶解性有机质(dissolved organic matter, DOM)是具有不同官能团和分子结构的芳香族和脂肪族有机化合物的复杂多相混合物[1],富含碳、氮、磷等多种生物需要的有机物质,在各种水体中具有多种地球化学和生态功能[2],DOM的形成、转化和命运及其伴随的养分再生过程是水生生态系统生物地球化学循环的关键环节,此外DOM作为能量和营养的重要来源,对水生生态系统中浮游植物和细菌的生物活性具有重大影响,在内陆湖泊爆发藻华过程中也起重要作用[3]。三维荧光光谱技术(EEMs)用于DOM来源及动力学的研究,具有灵敏度高、样品用量少、重复性好且不易损坏样品的特点[4],近年来被用于追踪其在自然水域中的变化,如河流、湖泊、水库[5]等,已经成为地球化学、环境化学和海洋化学等领域关注的热点。
银川市是西北干旱半干旱区典型的绿洲区域,受其地貌类型、气候、土壤等自然条件影响,形成了全球范围内荒漠半荒漠地区少见的高原湿地,是西北干旱半干旱区人工绿洲生态系统的有机组成部分,是黄河中上游重要的保水、蓄水和调水基地,也是银川市具水源保持、水质净化、蓄洪防旱、气候调节等重要功能的生态资源[6]。自20世纪以来,银川湿地大规模的农垦开发,开创了湖泊湿地的多重利用、全面利用的局面,从湿地垦殖到水利工程建设、渔业养殖再到旅游休闲和城镇建设,湿地利用方式具有越来越多样性、深度化的特征,产生了良好的经济、生态和社会效益的同时也对湿地生态环境造成了一定的不利影响[7]。而对于银川市DOM的研究还未见报道。
了解银川市湿地表层水体DOM的组成分布,探明DOM在银川市湿地中的组分信号及来源,以期为银川市湿地资源的综合管理与水资源的健康评价提供基础依据,为当地有关部门对湿地资源的开发利用提供参考依据,同时为湿地的可持续利用发展与实施湿地修复治理工程提供科学依据。
-
银川市(38°08′—38°53′N,105°49′—106°35′E)位于宁夏回族自治区境内,地处中温带干旱区,属大陆性气候,日照充足,蒸发强。全市湿地总面积达5.31万公顷,市内沟渠纵横,湖泊棋布,自然湖泊近200处,市区湿地率达到10.65%[8],荣获全球首批“国际湿地城市”的称号。
-
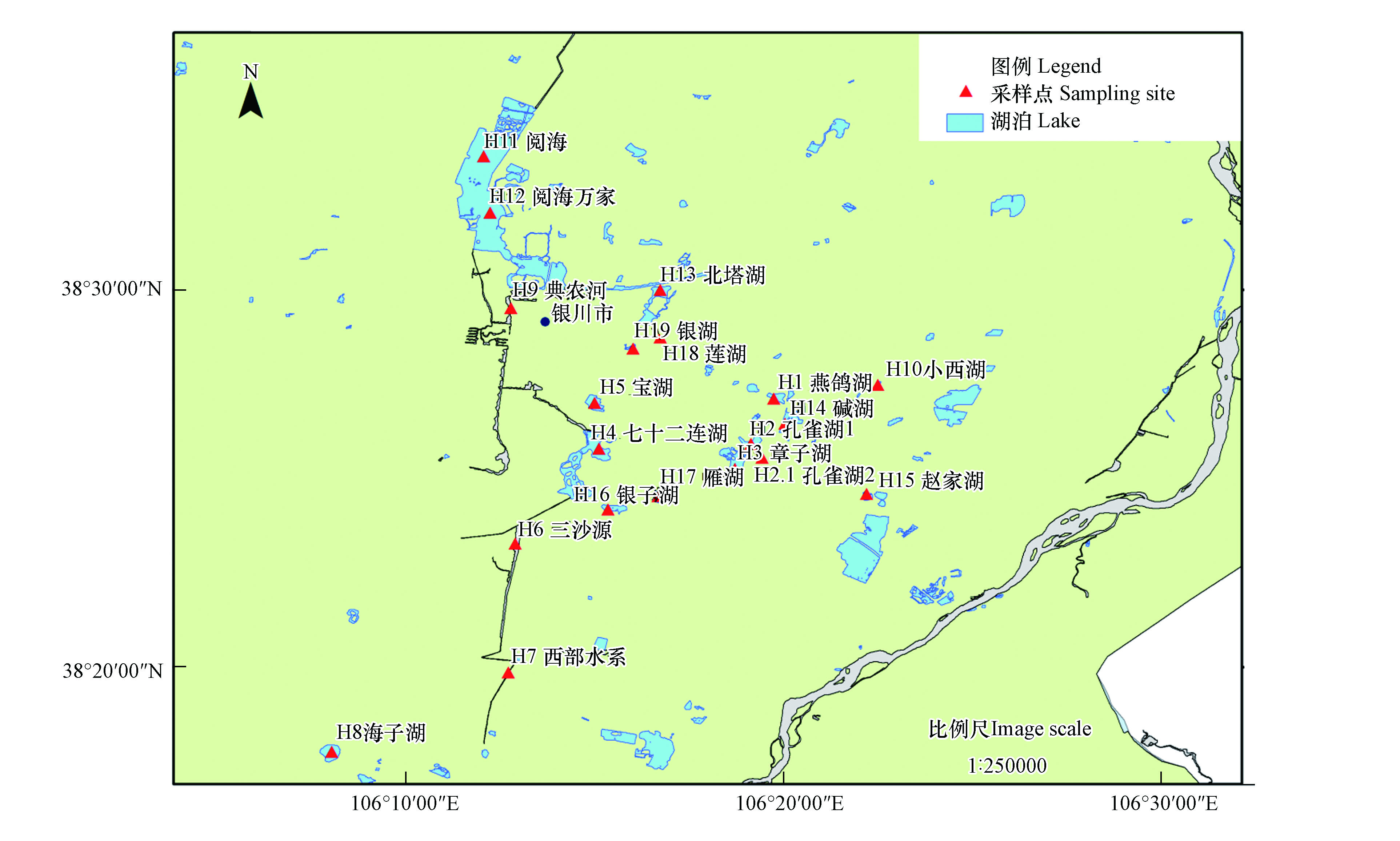
共采集186个湿地表层水样品,包括20个采样点。H1:燕鸽湖、H2:孔雀湖1、H2.1:孔雀湖2、H3:章子湖、H4:七十二连湖、H5:宝湖、H6:三沙源、H7:西部水系、H8:海子湖、H9:典农河、H10:小西湖、H11:阅海、H12:阅海万家、H13:北塔湖、H14:碱湖、H15:赵家湖、H16:银子湖、H17:雁湖、H18:莲湖、H19:银湖。湿地采样点如图1所示。
本研究将银川市湿地分为3个区域A(H1、H2、H2.1、H6、H14、H15)、B(H4、H5、H10、H11、H12、H13、H16、H17、H18、H19)、C(H3、H7、H8、H9),其中A区靠近老式居民区,湖泊内挺水植物数量较多,开发利用程度较低;B区湿地开发程度较高,主要为休闲娱乐及城镇建设,例如湿地公园、沿湖房地产的开发,受到人为因素干扰严重;C区为自然湿地,水源补给主要为农田灌溉水,周边土地主要为农田及林地。根据采样原则合理布设采样点,采样日期为2019年9月—10月,采样前后无降雨的发生,排除降雨对结果的影响,采集的各表层水样放入经酸泡过的棕色玻璃瓶中运回实验室冷藏,所有采集水样均经0.45 µm的聚醚砜(PES)滤膜过滤,滤后水样放置于−4 ℃保存并于1周内进行相关指标的测定。
-
实验室水样温度与室温一致后,使用装有150 W氙灯的日立F-4600荧光广谱仪进行EEM光谱的测定,光谱的激发波长(Ex) 220—450 nm,扫描间隔为5 nm,发射波(Em) 260—600 nm,扫描间隔为1 nm,扫描速度为1200 nm·min−1,光电倍增管电压为700 V,响应时间为0.05 s,激发与发射波长的狭缝宽度均为5 nm。荧光相关参数描述如表1所示。利用Milli-Q超纯水扣除空白,所有数据以超纯水EEM中350 nm下的荧光强度定标为拉曼单位(R.U.),并结合Delaunnay三角形内差值法修正去除拉曼散射和瑞利散射[4],为了最小化内滤效应,DOC浓度高于10 mg·L−1的样品同等倍数的稀释处理,确保样品的DOC浓度低于10 mg·L−1,以下各项光谱特征参数均以矫正过的数据计算。
-
区域积分法(FRI)是基于一致的激发波长(Ex)和发射波长(Em)将每个EEM数据划分为五个区域,通过计算指定区域的标准体积(
$ \varPhi _{{i}{, {\rm{n}}}} $ )与荧光响应百分比($ {{P}}_{ {i}{, {\rm{n}}}} $ )来表示特定结构荧光物质的含量与相对含量,相应的计算公式如下:式中,
$ {\rm{d}}\lambda _{\rm{Ex}} $ 是激发波长间隔,$ {\rm{d}}\lambda _{\rm{Em}} $ 是发射波长间隔,$ I\left( {{\lambda _{{\rm{Ex}}}}{\lambda _{{\rm{Em}}}}} \right) $ 是每个激发发射波长对的荧光强度;MFi是倍乘系数,为总的荧光区域积分面积与某一荧光区域i的积分面积的比值。 -
尽管可以使用区域积分分析来定量分析EEM谱图并确定DOM的组分及水平,但因为各种荧光峰的重叠,传统的“峰值采摘”技术在解释EEM数据集的多维性质方面存在问题,而EEM与PARAFAC相结合,可提供比传统的峰提取技术更高的EEM荧光成分的分辨率[11]。
PARAFAC是适用于三或高阶矩阵中排列的数据的多路方法,采用交替最小二乘原理的迭代型三维数阵分解算法,将数据信号降维成唯一荧光合适的荧光组分集和一个残差矩阵[12],在本次研究中将三维荧光信号解析为若干个具有唯一对应发射波长极值的荧光组分。通过Matlab2012a软件,采用N-way和drEEM工具箱,对研究区域内湖泊表层水体的186个EEMs矩阵进行平行因子分析,识别的荧光组分访问荧光在线光谱数据库(http://www.openfluor.org)进行匹配,用Fmax (单位R.U.)值评估EEM-PARAFAC分析确定的荧光组分强度和组分最大荧光强度的相对百分比在空间上的分布[13]。
-
使用SPSS进行主成分分析、非参数检验以及相关统计指标的描述,使用Origin进行相关图表的绘制,使用ArcGIS绘制采样点布设图的绘制,使用MATLB 2012a进行EEMs的平行因子、区域积分的分析和相关指标的计算。
-
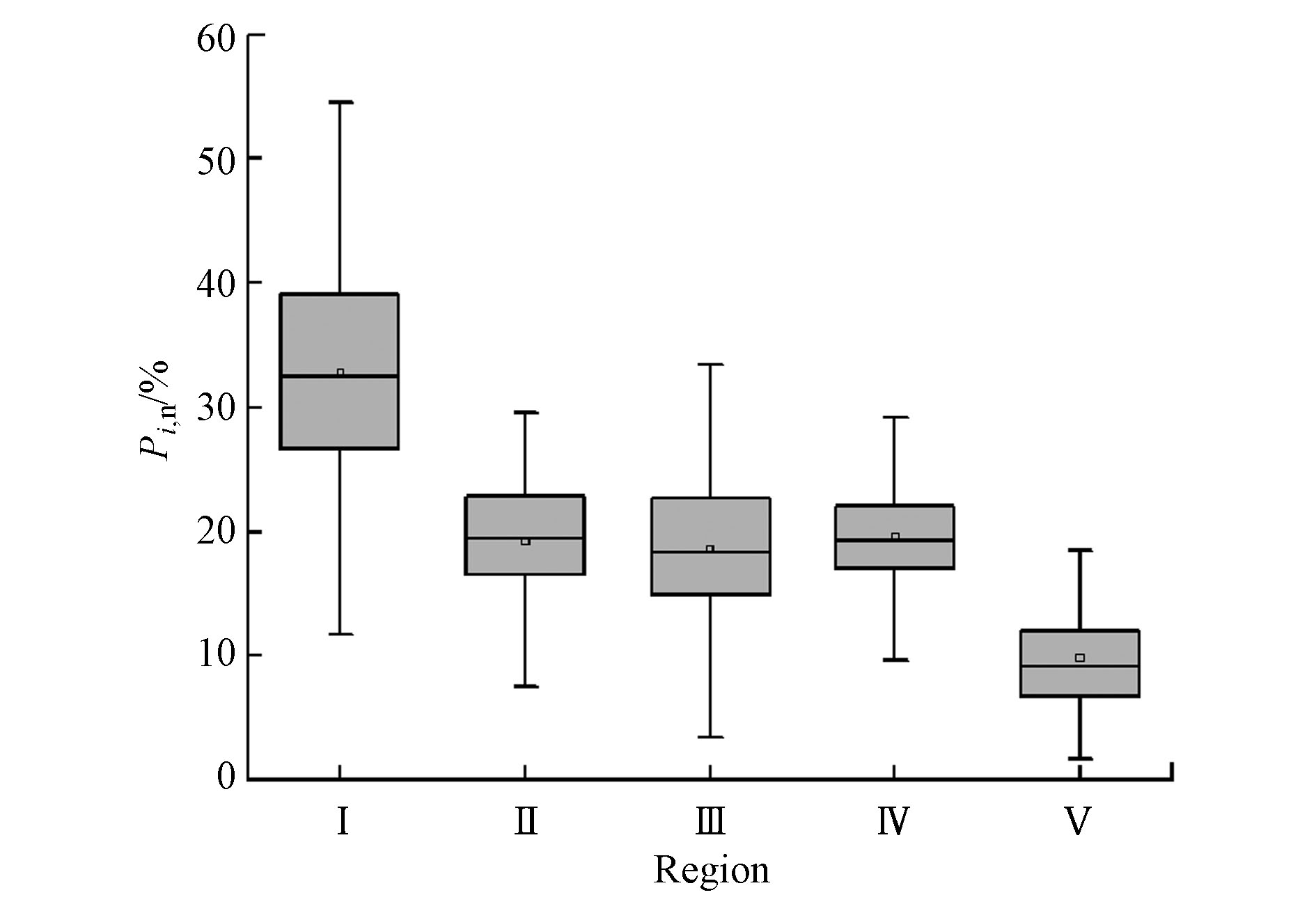
对于来自银川湿地表层水体的DOM的EEM进行了区域荧光法(FRI)解析,每个DOM的EEM被分为5个区域:区域I(Ex/Em=(220—250)/(260—330)nm)为酪氨酸样蛋白;区域Ⅱ(Ex/Em=(220—250)/(330—380) nm)为色氨酸样蛋白;区域Ⅲ(Ex/Em=(220—250)/(380—600) nm)为黄腐酸;区域Ⅳ(Ex/Em=(250—450)/(260—380) nm)为溶解性微生物代谢产物;区域Ⅴ(Ex/Em=(250—450)/(380—600) nm)为腐殖质样物质;使用EEM-FRI分析计算各激发发射区域的荧光百分比
$ {P}_{ i, {\rm{n}}} $ 值,各区域之间存在显著差异,结果如图2;区域Ⅰ—Ⅴ的荧光百分比范围分别为11.73%—67.56%、4.06%—34.25%、4.06%—33.40%、8.97%—38.19%、1.68%—25.55%,均值表示本次研究的DOM的区域荧光百分比最大的是区域Ⅰ,超过30%,其次是区域Ⅳ、Ⅱ、Ⅲ、Ⅴ,分别为19.64%、19.17%、18.55%和9.83%,这些结果表明,银川市湿地水体DOM的主要成分为酪氨酸样蛋白。 -
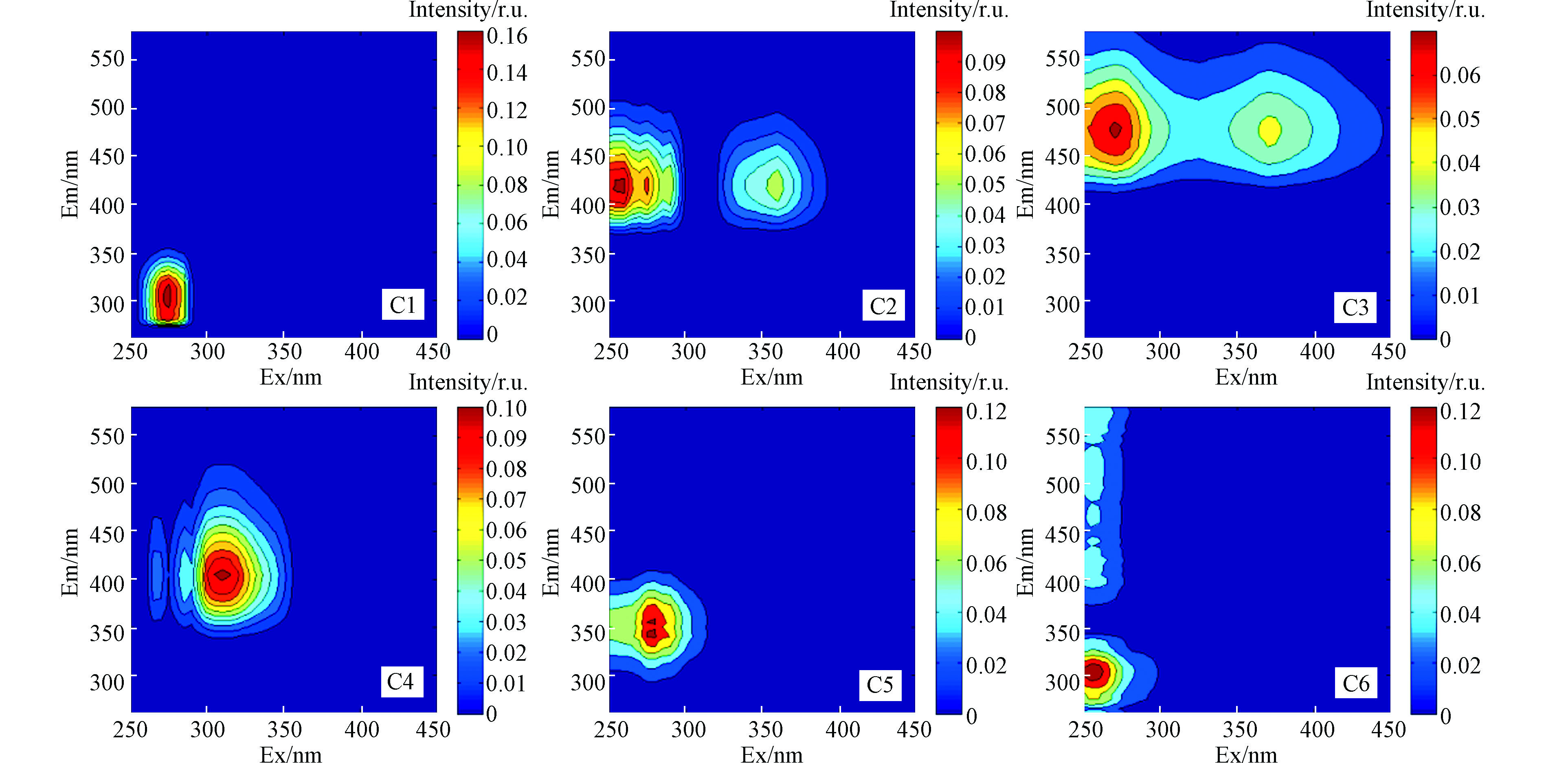
通过平行因子法(Parallel factor analysis, PARAFAC)对银川市湿地表层水体样品进行三维荧光数据解析,分析DOM的组分构成。银川市湿地表层水体DOM主要解析出6个荧光组分,水体中DOM荧光组分的荧光组分(C1、C2、C3、C4、C5、C6)及最大激发、发射波长分布如图3、4,与同类研究结果对比见表2。
银川市湿地表层水体组分图谱中主要存在2个类蛋白质组分(C1、C5),3个类腐殖质组分(C2、C3、C4)和酪氨酸样与陆地腐殖质成分的混合样(C6)。其中C6组分的荧光峰位置为255/305(主)、400、505 nm(Ex/Em),其中主要发射峰处与Bridgeman等[14]研究的酪氨酸B1峰((225—237)/(309—321) nm)相似,次要发射峰处与Singh等[15]研究的土壤腐殖质(250、410/520 nm)组分相似,此外PARAFAC无法将C6中的酪氨酸样和土壤衍生的腐殖质样特征区分开,可能是由于这两种类型的荧光团之间的相互作用[16];C1组分的荧光峰位置为275/300 nm(Ex/Em),主要成分为短波(紫外区)类酪氨酸,对应传统峰B((270—280)/(300—320) nm)[17],与简单的苯酚的荧光团有关,通常表示降解程度较高的“较旧”的蛋白质,由高等植物和藻类产生,提示近期的生物活性[18];C5组分的荧光峰位置为275/340、355 nm(Ex/Em),主要成分为类色氨酸,对应传统峰T(270—280)/(330—370) nm),通常表示降解程度较低的“新鲜蛋白”,来源于水体自生过程[19],提示近期卫生污水的污染;C2在260、275、290、300 nm处分别有明显的激发峰,最大发射波长为425 nm,主要成分为微生物腐殖质,与微生物的活性呈正相关[20-21];C3组分的荧光峰位置为270、375/480 nm(Ex/Em),对应传统峰C((320—360) /(400—460) nm),但峰值明显向长波长移动,表现为结构的疏水性增加,主要成分为红移的陆地腐殖质[22];C4组分的荧光峰位置为310/405 nm(Ex/Em),主要成分为海洋腐殖质,对应传统峰M((290—320)/(370—420) nm),由新产生的荧光类腐殖酸材料组成,是近期生物活性的一个标志[21]。
-
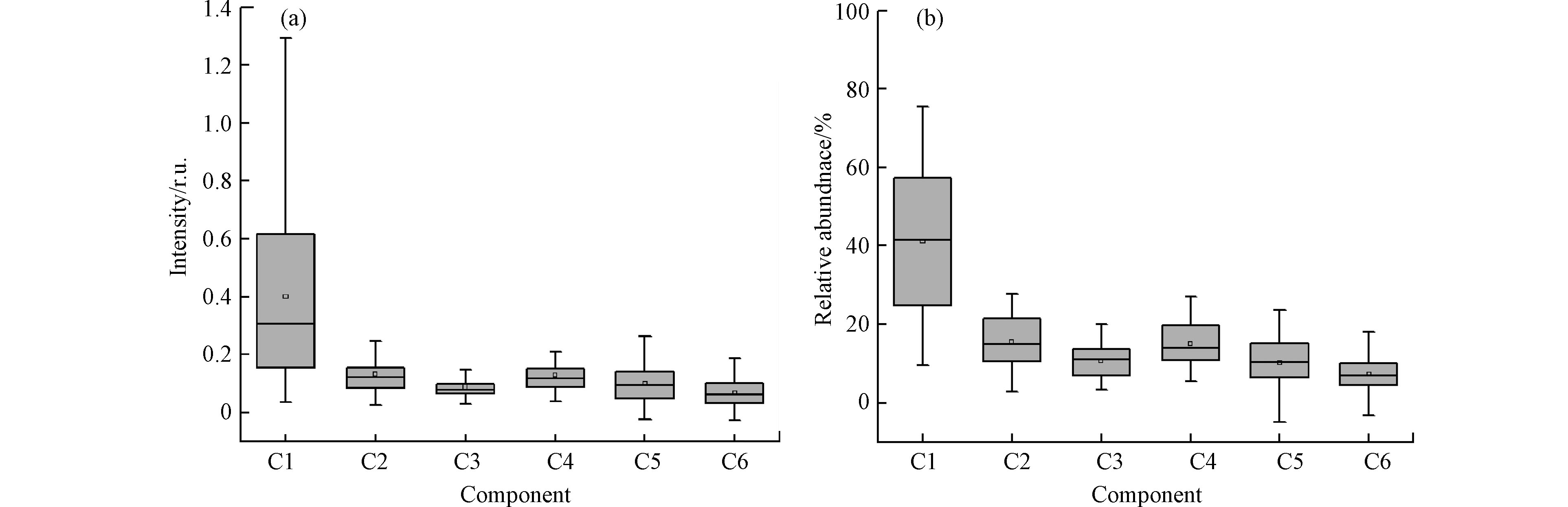
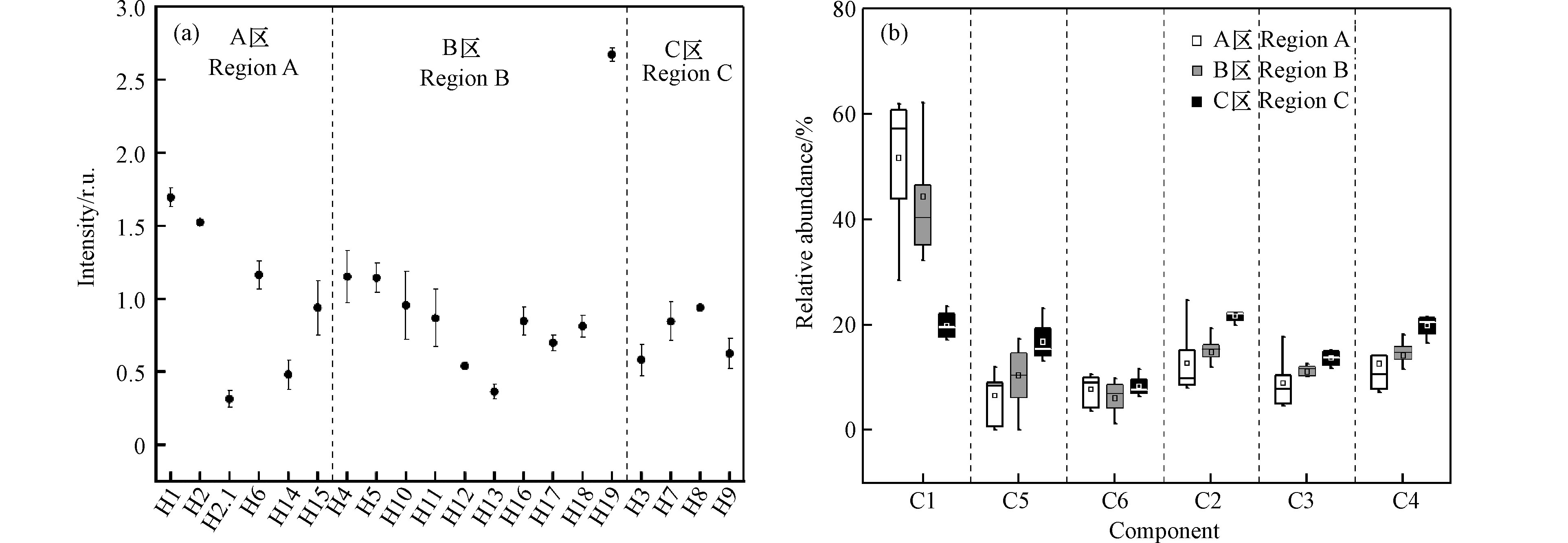
湿地水体6种DOM荧光组分荧光强度如图5(a)所示。结果表明,表层水体中C1、C2、C3、C4、C5、C6组分荧光强度的变化范围分别为:0.035—1.291、0.024—0.521、0.028—0.317、0.037—0.492、−0.024—0.468、−0.027—0.187,平均值分别为0.400、0.132、0.088、0.129、0.101、0.066。各荧光组分强度明显不同,组分1(酪氨酸样蛋白)明显高与其他组分,表明整体来看银川湿地水体DOM的主要成分为酪氨酸样蛋白,与FRI分析结果相符。
图5(b)为6种荧光组分的荧光相对丰度。结果表明,表层水体中C1、C2、C3、C4、C5、C6荧光组分占比的变化范围分别为9.48%—75.48%、2.76%—27.73%、3.24%—20.04%、5.37%—27.00%、−4.80%—23.71%、−3.25%—20.35%,平均值分别为41.21%、15.54%、10.69%、15.10%、10.30%和7.20%,各组分荧光丰度明显不同,其中C1组分相对含量最大,超过40%(41.21%),其次为C2(15.54%)、C4(15.10%)、C3(10.30%)、C5(10.69%),相对含最小为C6(7.20%)。上述结果一致表明银川市湿地水体DOM的主要成分为C1(酪氨酸样蛋白)。蛋白质成分在DOM组成占较高比例表现为水体生产力提高,受自然因素作用之外也有可能受到人为因素的影响,因此银川市湿地水体DOM的蛋白质占比较大,原因有可能是受到人类活动产生的各种污染物的输入;同时由于废水输入对水生植物和藻类产生影响,导致微生物活性的增加,使得水体生产力的提高,内源负荷也相应提高。
-
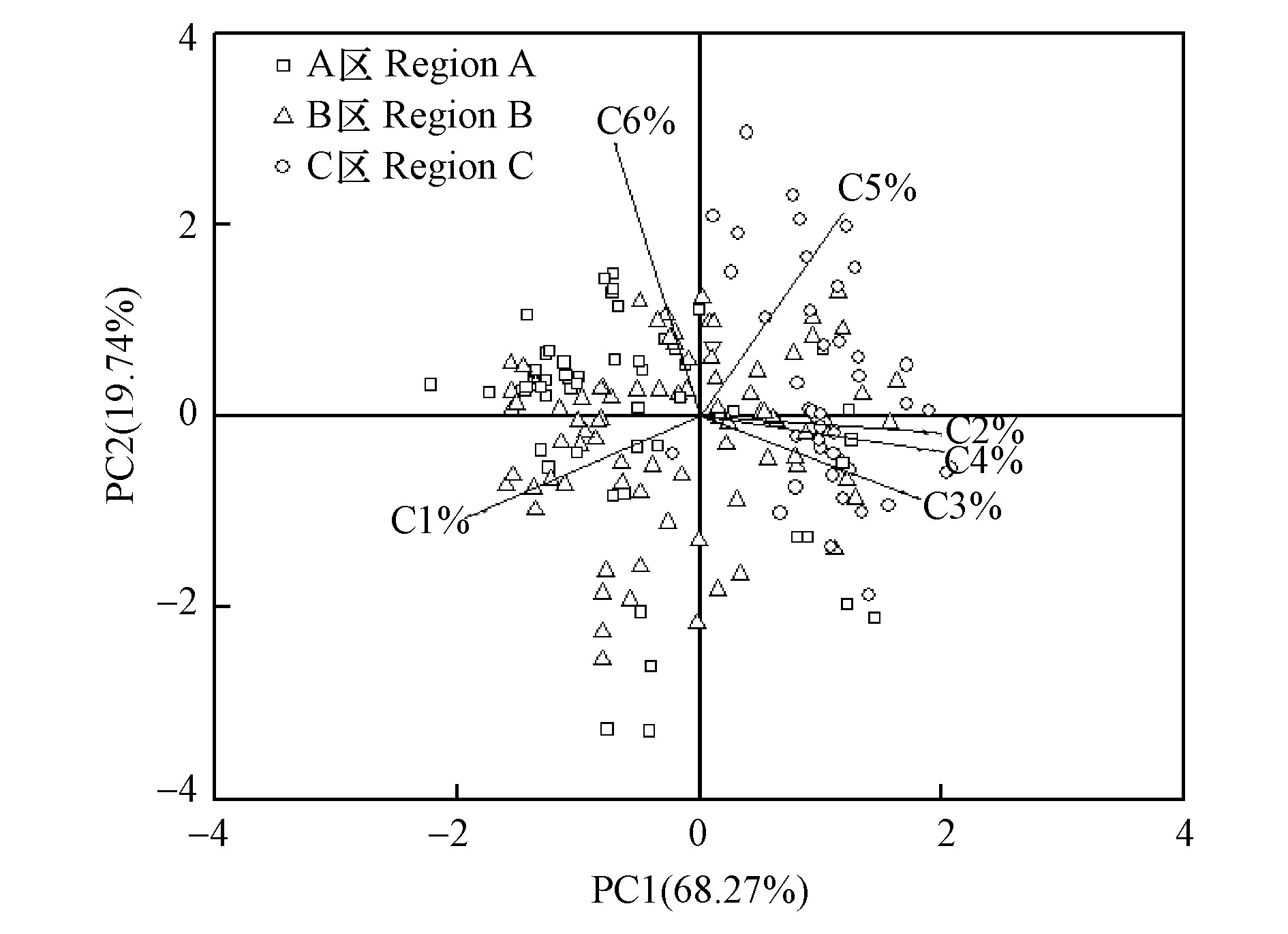
对EEM-PARAFAC分量(C1—C6)的Fmax百分比结果进一步进行了PCA分析,可以有效的识别出表层水体DOM组分信号特征。为确保提取的主成分有足够的影响,其根据特征值>1与碎石图最终确定保留前两个主成分,结果如图6所示,因子载荷矩阵提取的PC1解释了总体方差的68.27%,PC2解释了总体方差的19.74%,两者共同解释了总体方差的88.00%。变量C2、C3与C4主要对PC1有所贡献;而变量C1也可以由PC1更好地表示,但呈负相关;变量C5在PC1与PC2都有贡献,但在因子1上有较高的载荷;变量C6主要对PC2有所贡献。
如图6所示,不同研究区域有不同的图标来表示,结果显示不同特征区域呈现显著差异,区域内各水样采集区差异不明显。其中A区为PC1的贡献,但为负相关,与变量C1呈显著正相关,表明该区域的DOM主要成分为C1,其区域内丰富的挺水植物起重要贡献作用;B区在PC1与PC2各占有一定比例的贡献,在PC1贡献较大,表明该区DOM的组分及来源较广,与该区域高程度的开发有关,受到人为干扰的影响较大;C区主要为PC1的贡献,且为正相关,与变量C2、C3与C4呈正相关,说明C区的DOM成分主要为类腐殖质的贡献,因为C区水源补给为农田灌溉退水,周边农田及林地的外源输入以及水生生物代谢产生等自然活动产生,受到人为干扰较小。
-
图7(a)为各研究区域的总荧光强度,结果显示,表层水体荧光总值CT荧光强度的变化范围在0.240—2.780之间,平均值为0.915,结合多个独立样本间的非参数检验结果显示,个别研究区域内部的采样点之间存在显著差异(P<0.05),但整体来看呈现A区稍微大于B区大于C区的现象,一方面与不同研究区域周边环境与土地的利用类型有关,另外一方面由受到水源补给、水体本身源的影响,当然与人类活动的干扰更密不可分,A区内采样点差异明显,H1、H2明显高与其他采样点,H2.1、H14明显低于其他采样点,其中H1靠近燕鸽湖基地,是银川最大的生活小区,受到人类活动的干扰较大,H2临近渔业养殖,对水体植物产生直接影响,而同为孔雀湖的H2.1孔雀湖后段CT明显低,说明该区域水质状况较好,H14与B区H12、H13荧光值低是因为几处相互贯通,水源补给为黄河补水,水质循环较好,荧光高值H19位于公园内部,周围为商业街区,受到高强度的人员流量的干扰,生活污水的输入量较大。
整体来说银川市湿地水体DOM的类蛋白质组分(C1+C5+C6)占比水平稍微大于类腐殖质组分(C2+C3+C4),分别为58.68%与41.32%.图7(b)为各研究区域的荧光丰度占比情况。结果表明,各组分相对含量的空间分布结果表明,C1组分呈现明显的A区>B区>C区,C6组分相当,C5、C2、C3与C4呈现出A区<B区<C区的趋势,这与各区域周边环境等因素密切有关,A区挺水植物丰富并且住宅区生活污水的排放对C1组分起到主要贡献作用,B区的开发利用程度较高,住宅建设与湿地公园等休闲娱乐项目的开发,高强度的人为干扰,同时大面积的绿化建设使得B区DOM的来源较广,既有居民商业污水的输入,又有陆源植物腐化经雨水充刷等陆源输入,导致该区域各组分含量都处于较高水平,C区属于天然湿地,以农田与林地为主,大量的陆地植物的凋零产生丰富的陆源腐殖质,由农田灌溉退水以及雨水冲刷的自然条件进入水体,造成C区类腐殖质部分(C2、C3、C4)明显高与其他区域。
-
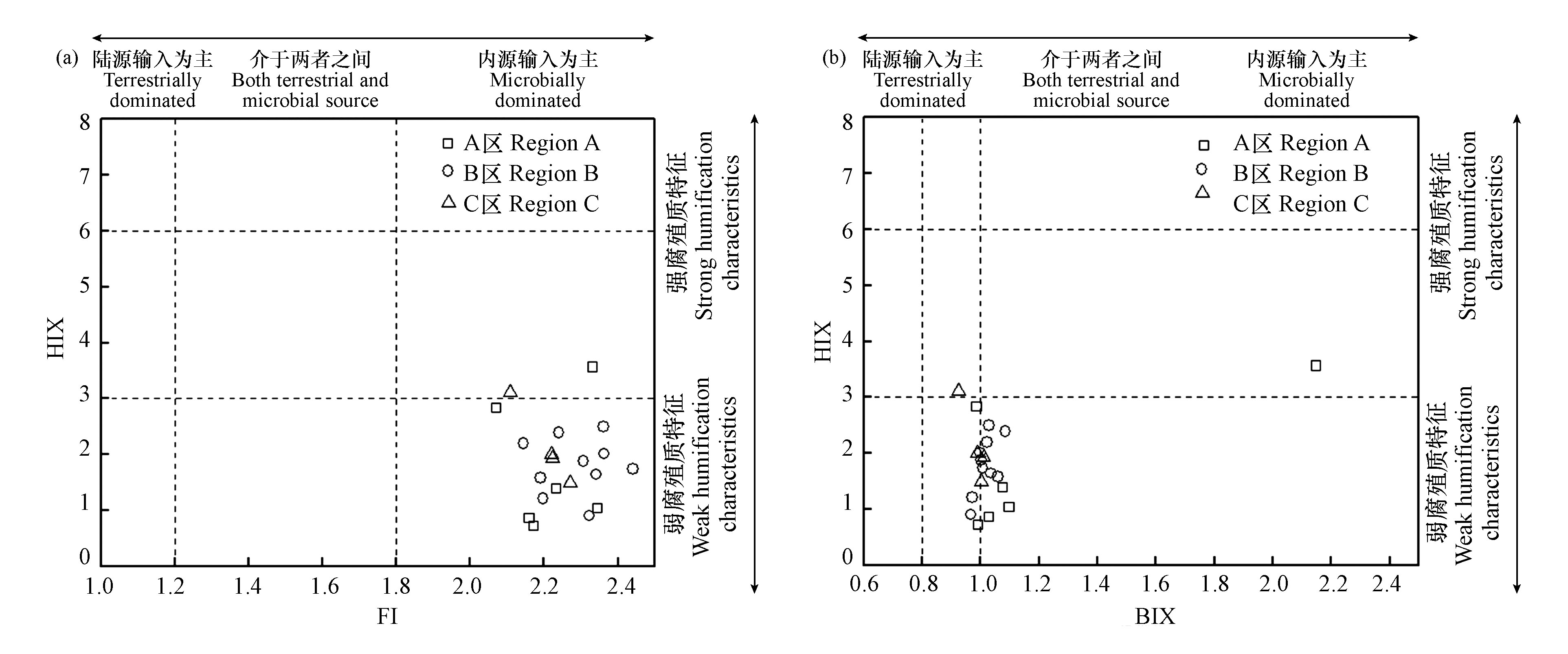
湿地水体DOM的来源主要分为陆源和内源两种,陆源主要由陆地生态系统微生物降解或者动植物残体残渣等腐烂产生的腐殖质物质,由地表径流、雨水冲刷等进入水体;内源主要由水体微生物、浮游生物、藻类等生物活性产生的蛋白质物质[28]。荧光光谱特性可以有效表征DOM组分,提供来源解析,因此本文对湿地水体DOM的荧光特征参数(FI、BIX、HIX、Fn280、Fn355)进行了分析,结果如图8;
荧光指数(FI)可以鉴别陆源和自生源的DOM,结果如图8(a),FI值的范围在1.82—2.73之间,均值为2.23±0.17,整体来说大于1.8,表明湿地水体DOM的来源主要为本土来源,表现出较强的自生源特征。自生源指数(BIX)反映了DOM溯源及自生源的贡献比例,结果如图8(b),范围在0.83—1.36之间,均值为1.01±0.09,整体来说大于1,表明水体DOM的来源由陆源与自生源混合产生,其中新进生物或细菌引起的自生源为主,陆源贡献较少。腐殖化指数(HIX)可以区分不同腐殖化程度的DOM,结果如图8(a、b),范围在0.38—6.32之间,均值为1.85±1.07,整体来说小于3,表明湿地水体具有较弱的腐殖质化特征并且具备重要的新近自生源的贡献。
Fn280代表类蛋白质物质相对浓度水平,Fn355代表类腐殖质物质相对浓度水平,这两个指标分别用来表示内源与陆源对水体DOM组分的贡献[10]。本次研究的Fn280的范围在0.031—0.757(R.U.)之间,均值为0.25±0.14(R.U.),Fn355的范围在0.028—0.395(R.U.)之间,均值为0.10±0.05(R.U.),整体水平来看各区域内差异明显,但Fn280明显高于Fn355,都呈现处该区域的自生源明显的特征。综上荧光光谱各特征参数的分析得出,银川市湿地水体DOM,研究各区域虽有差异,但总的来说DOM的来源呈现出陆源-自生源复合状态,但内源特征占主要部分,腐殖化程度较弱,且类蛋白物质含量和占比较高,新生的DOM占比较多。
-
与已有的国内外研究结果相比较(表3),整体看来,国内高原亚高原地区的天才湖、百花湖DOM的腐殖化水平与来源相似,而位于内蒙古境内半干旱区湿地的乌梁素海的腐殖化程度较低,内源性作用更大,主要是因为该湿地作为主要灌溉工程的同时还接受了来自上游工业废水与生活污水的污染,相比较而言,国内湖泊比国外湿地沼泽(埃夫罗斯河、南卡罗来纳州沿海湿地、弗罗里达沿海大沼泽)DOM的来源相似均是混合来源,但国外湿地沼泽的陆源比重较大,且腐殖化程度更高。银川湿地DOM的FI指数、BIX指数明显较大、HIX指数明显较小,即使与用于城市污水等其他水源处理的奥兰治县湿地、受到油井影响较大的加利福尼亚南部盐沼湿地相比,DOM的内源性明显且腐殖化程度低,与富营养化程度较高的大型浅水湖泊太湖较接近,主要是因为银川市湿地的多样多重的开发利用,围湖住宅,湿地公园等休闲娱乐场所的修建,给湿地湖泊带来了较大的人为负担,提示在对湿地资源开发利用的同时要兼顾水资源的保护以及湿地资源的可持续发展。
-
(1)利用PARAFAC法与FRI法银川市湿地表层水体DOM三维荧光光谱矩阵进行分析,FRI法将EEM光谱数据划分为五个激发发射区域;区域Ⅰ(酪氨酸样蛋白)、区域Ⅱ(色氨酸样蛋白)、区域Ⅲ(黄腐酸)、区域Ⅳ(溶解性微生物代谢产物)、区域Ⅴ(腐殖质样物质);PARAFAC共解析出6种荧光组分:C1(类酪氨酸物质)、C2(微生物腐殖质)、C3(红移的陆地腐殖质)、C4(海洋腐殖质)、C5(类色氨酸物质)和C6(PARAFAC未能分离的酪氨酸样和陆地腐殖质物质),FRI各区域荧光百分比(
$ {{P}}_{{i}{,{\rm{n}}}} $ )、PARAFAC各组分Fmax与荧光相对丰度占比一致表示湿地水体DOM主要成分为酪氨酸样蛋白。(2)各研究区域DOM组分的空间分布结合多个独立样本的非参数检验、主成分分析证实各研究区域荧光强度及组分信号存在显著差异,其差异主要受到湿地开发利用程度的高低,湖泊水源补给,周围土地利用类型的影响,但整体来说银川市湿地水体DOM污染类型为类蛋白质主导型。
(3)荧光光谱特征参数分析可得,银川市湿地表层水体DOM的来源由自生源与陆源的双重特征,但以自生源特征为主,且新生DOM占比较大。与国内外其他沼泽湖泊相比,腐殖化程度较低,内源性占比较重,处于较高水平。
利用光谱分析法表征银川市湿地水体中溶解性有机质的特征
Characterization of dissolved organic matter in the surface water of the Yinchuan Wetlands using spectroscopic analysis
-
摘要:
为了研究银川市湿地表层水体中溶解性有机质(DOM)的光谱特征、空间分布及其来源,对银川市20个采样点采集的186个湿地表层水样进行了三维荧光光谱技术(EEMs)结合区域积分法(FRI)、平行因子分析法(PARAFAC)以及荧光指数法的分析。结果表明,银川市湿地水体DOM主要包括6种组分:C1组分(类酪氨酸物质)相对含量最大,占41.21%,其次为C2(微生物腐殖质),占15.54%、C4(海洋腐殖质),占15.10%、C3(红移的陆地腐殖质),占10.30%、C5(类色氨酸物质),占10.69%,相对含最小为C6(未能分离的酪氨酸样和陆地腐殖质物质),占7.20%,DOM的组分信号为蛋白质主导型;空间分布结合主成分分析显示,银川市湿地水体各研究区域DOM差异显著,主要受到湿地开发利用程度,湖泊水源补给,周围土地利用类型的影响;荧光光谱特征参数分析结果显示,银川市湿地表层水体DOM的来源为陆源-自生源复合型,但自生源特征明显,且新生的DOM的比重较大。
-
关键词:
- 溶解性有机质(DOM) /
- 银川湿地 /
- 三维荧光光谱(EEMs) /
- 区域积分(FRI) /
- 平行因子分析(PARAFAC)
Abstract:In order to explore the sources, spatial distribution and spectral characteristics of the dissolved organic matter (DOM) in surface waters of Yinchuan wetlands, 186 water samples were collected from 20 sampling sites. The samples were analyzed by the three-dimensional fluorescence spectroscopy (EEM), the fluorescence regional integration (FRI), the parallel factor analysis (PARAFAC), and the Fluorescence index method, respectively. The results revealed that six types of components exist in the DOM, including the C1 component (tyrosine-like humus) with the largest ratio (41.21%), the C2 moiety (microbial humus) accounting for 15.54%, the C4 component (marine humus) with the proportion of 15.10%, the C3 (redshifted terrestrial humus, 10.30%) and C5 components (tryptophan-like humus, 10.69%), the C6 element (the mixture of tyrosine-like humus and terrestrial humus) with the lowest ratio of 7.20%. It is observed that the component of DOM was dominated by protein. Moreover, the combination of spatial distribution and principal component analysis indicated that there were significant disparities in different research regions of Yinchuan wetlands, which was mainly affected by the development level of the wetlands, the water supplies from the lake, as well as the land use type. The feature analysis of fluorescence spectra pointed out that the source of DOM in the surface waters of Yinchuan wetlands was a complex of terrigenous-authigenic mode, and the authigenic component was predominant with a major proportion of new DOM.
-

-
表 1 三维荧光光谱相关参数描述
Table 1. Description of fluorescence spectrum parameters
光谱参数
Fluorescence parameter参数定义
Parameter definition参数相关描述
Parameter description荧光指数(FI) Ex=370 nm时,Em=470 nm与
520 nm处的荧光强度比值;作为物质来源的指示指标,对荧光组分及指标的生态定义中指出
FI>1.8以自生源为主,FI<1.2以陆源输入为主[9]。腐殖化指数(HIX) Ex=254 nm时,435—480 nm间的
荧光峰值与300—345 nm之间的
荧光峰值积分之商反映水体DOM的腐殖化程度,其值小于3表明DOM呈微弱腐殖化
特征且有重要的近期自生源,3—6则表示DOM呈强腐殖质特征,
具有微弱的新进自生源,大于6表明DOM呈强腐殖质特征
和重要的陆源贡献[9]。自生源指数(BIX) Ex=310 nm时,Em在380 nm和
430 nm处荧光强度的比值;反映水体DOM自生源贡献,其值在0.6—0.8表明自生源贡献较少
主要为陆源输入,大于1时主要为生物或细菌等来源,0.8—1.0则
表明DOM来源介于两者之间[10]。Fn280 Ex=280 nm时,Em在340—
360 nm间最大的荧光强度;代表类蛋白质物质相对浓度水平[10]。 Fn355 Ex=355 nm时,Em在440—
470 nm间最大的荧光强度;代表类腐殖质物质相对浓度水平[10]。 表 2 银川湿地水体样品DOM的荧光组分特征
Table 2. Characteristics of fluorescent components in DOM of Yinchuan Wetland water
组分
ComponentsEx/nm
Em/nm 类型
TypeOpenFluor匹配数目
Matches同类研究比较/nm
Comparison of similar studiesC1 275 300 类酪氨酸
(类蛋白质物质)11 270/380[18];284,270/302[23] C2 260/275/290/360 425 微生物腐殖质
(类腐殖质物质)2 260,360/422[20];355/424[21] C3 270/375 480 红移的陆地腐殖质
(类腐殖质物质)57 <275,370/475[24];260/365,476[22] C4 310 405 海洋腐殖质
(类腐殖质物质)4 315/410[21];<300/396[25] C5 275 340/355 类色氨酸
(类蛋白质物质)40 275/330[26];280/340[19] C6 255 305/400/505 酪氨酸样和
陆地腐殖质1 <250/436[27];250/30,540[26] 表 3 银川市湿地DOM荧光指数与国内外其他地区湿地的比较
Table 3. Comparison of characteristic parameters of fluorescent light in the wetland waters from the different regions
区域Regions FI HIX BIX 文献References 银川湿地 1.82—2.73(2.23) 0.38—6.32(1.85) 0.83—1.36(1.01) 本研究 太湖(长江三角洲) 1.65—2.50(1.93) 0.20—2.66(0.56) 0.84—1.48(1.12) [3] 天才湖(云贵高原) 1.51 4.25 — [29] 百花湖(西南高原) — 2.88—5.63 0.76—0.83 [30] 乌梁素海(内蒙古) 1.594—1.746 1.514—5.012 [31] 埃夫罗斯河(保加利亚、土耳其、希腊) — 0.75—9.7 0.57—0.9 [32] 弗罗里达沿海大沼泽(弗罗里达) 1.28—1.47 4.5—16.0 0.4—0.9 [33] 南卡罗来纳州沿海湿地(美国) 1.30—1.54 4.18—16.7 — [34] 南加州奥兰治县湿地(美国) 1.47—1.56 — 0.70—0.83 [35] 加利福尼亚南部盐沼(美国) — 0.8±0.3 0.6±0.2 [36] 注:“—”表示未报道。Note: “—” unreported. -
[1] SONG F, WU F, FENG W, et al. Fluorescence regional integration and differential fluorescence spectroscopy for analysis of structural characteristics and proton binding properties of fulvic acid sub-fractions [J]. Journal of Environmental Sciences, 2018, 74: 116-125. doi: 10.1016/j.jes.2018.02.015 [2] SEPP M, KOIV T, NOGES P, et al. Do organic matter metrics included in lake surveillance monitoring in europe provide a broad picture of brownification and enrichment with oxygen consuming substances? [J]. Science of The Total Environment , 2018, 610-611: 1288-1297. [3] WEIWEI L, XIN Y, KEQIANG S, et al. Unraveling the sources and fluorescence compositions of dissolved and particulate organic matter (DOM and POM) in lake Taihu, China [J]. Environmental Science and Pollution Research, 2019, 26(4): 4027-4040. doi: 10.1007/s11356-018-3873-2 [4] 沈烁, 王育来, 杨长明, 等. 南淝河不同排口表层沉积物DOM光谱特征 [J]. 中国环境科学, 2014, 34(9): 2351-2361. SHEN S, WANG Y L, YANG C M, et al. Spectral characteristic of dissolved organic matter (DOM) in the surface sediments from different discharging points along the nanfei river in hefei city, anhui province [J]. China Environmental Science, 2014, 34(9): 2351-2361(in Chinese).
[5] MASSICOTTE P, ASMALA E, STEDMON C, et al. Global distribution of dissolved organic matter along the aquatic continuum: Across rivers, lakes and oceans [J]. Sci Total Environ, 2017, 609: 180-191. doi: 10.1016/j.scitotenv.2017.07.076 [6] 田大年, 党丽慧, 丁润梅, 等. 银川市湿地表层水中多环芳烃的分布、来源及生态风险评价 [J]. 环境科学, 2019, 40(7): 3068-3077. TIAN D N, DANG L H, DING R M, et al. Distribution, sources, and ecological risk assessment of polycyclic aromatic hydrocarbons in the surface waters of the yinchuan wetlands [J]. Environmental Science, 2019, 40(7): 3068-3077(in Chinese).
[7] 何彤慧, 王筱平, 高鹏. 银川平原湿地开发利用的历史经验 [J]. 宁夏农林科技, 2018, 59(7): 29-32, 43. doi: 10.3969/j.issn.1002-204x.2018.07.012 HE T H, WANG X P, GAO P. His torical experience of wetland development and utilization in yinchuan plain [J]. Ningxia Journal of Agri and Fores, 2018, 59(7): 29-32, 43(in Chinese). doi: 10.3969/j.issn.1002-204x.2018.07.012
[8] 谭鹏. 银川湿地保护与水资源可持续利用概述 [J]. 宁夏农林科技, 2016, 57(1): 51-52, 62. doi: 10.3969/j.issn.1002-204X.2016.01.020 TAN P. An overview of wetland protection and water resources sustainable utilization in Yinchuan [J]. Ningxia Journal of Agriculture and Forestry Science and Technology, 2016, 57(1): 51-52, 62(in Chinese). doi: 10.3969/j.issn.1002-204X.2016.01.020
[9] JASON B. FELLMAN, ERAN H, et al FELLMAN, ERAN H, et al. Fluorescence spectroscopy opens new windows into dissolved organic matter dynamics in freshwater ecosystems: A review [J]. American Society of Limnology and Oceanography, 2010, 55(6): 2452-2462. doi: 10.4319/lo.2010.55.6.2452 [10] 周石磊, 孙悦, 张艺冉, 等. 雄安新区-白洋淀冬季冰封期水体溶解性有机物的空间分布、光谱特征及来源解析 [J]. 环境科学, 2020, 41(1): 213-223. ZHOU S L, SUN Y, ZHANG Y R, et al. Spatial distribution, spectral characteristics, and sources analysis of dissolved organic matter from baiyangdian Lake in Xiong’an New District during the winter freezing period [J]. Environmental Science, 2020, 41(1): 213-223(in Chinese).
[11] YAO Y, LI Y Z, GUO X J, et al. Changes and characteristics of dissolved organic matter in a constructed wetland system using fluorescence spectroscopy [J]. Environ Sci Pollut Res Int, 2016, 23(12): 12237-12245. doi: 10.1007/s11356-016-6435-5 [12] MURPHY K R, TIMKO S A, GONSIOR M, et al. Photochemistry illuminates ubiquitous organic matter fluorescence spectra [J]. Environ Sci Technol, 2018, 52(19): 11243-11250. doi: 10.1021/acs.est.8b02648 [13] SANCHEZ N P, SKERIOTIS A T, MILLER C M. A PARAFAC-based long-term assessment of DOM in a multi-coagulant drinking water treatment scheme [J]. Environ Sci Technol, 2014, 48(3): 1582-1591. doi: 10.1021/es4049384 [14] BRIDGEMAN J, BIEROZA M, B, AKER A. The application of fluorescence spectroscopy to organic matter characterisation in drinking water treatment [J]. Reviews in Environmental Science and Bio/Technology, 2011, 10(3): 277-290. doi: 10.1007/s11157-011-9243-x [15] SINGH S, J. D'SA E, M. SWENSON E. Chromophoric dissolved organic matter (CDOM) variability in barataria basin using excitation–emission matrix (EEM) fluorescence and parallel factor analysis (PARAFAC) [J]. Science of the Total Environment, 2010, 408: 3211-3222. doi: 10.1016/j.scitotenv.2010.03.044 [16] CHEN H, LEI K, WANG X. Terrestrial humic substances in daliao river and its estuary: Optical signatures and photoreactivity to UVA light [J]. Environmental Science and Pollution Research, 2015, 23(7): 6459-6471. [17] EHNVALL B. Organic matter properties and their relation to phosphorus and nitrogen concentrations in swedish agricultural streams[D]. Uppsala: Sveriges lantbruksuniversitet, 2017. [18] PAINTER S C, LAPWORTH D J, WOODWARD E M S, et al. Terrestrial dissolved organic matter distribution in the north sea [J]. Sci Total Environ, 2018, 630: 630-647. doi: 10.1016/j.scitotenv.2018.02.237 [19] OSBURN C L, HANDSEL L T, MIKAN M P, et al. Fluorescence tracking of dissolved and particulate organic matter quality in a river-dominated estuary [J]. Environ Sci Technol, 2012, 46(16): 8628-8636. doi: 10.1021/es3007723 [20] WILLIAMS C J, YAMASHITA Y, WILSON H F, et al. Unraveling the role of land use and microbial activity in shaping dissolved organic matter characteristics in stream ecosystems [J]. Limnology and Oceanography, 2010, 55(3): 1159-1171. doi: 10.4319/lo.2010.55.3.1159 [21] LAMBERT T, BOUILLON S, DARCHAMBEAU F, et al. Effects of human land use on the terrestrial and aquatic sources of fluvial organic matter in a temperate river basin (the Meuse River, Belgium) [J]. Biogeochemistry, 2017, 136(2): 191-211. doi: 10.1007/s10533-017-0387-9 [22] CHEN M, JUNG J, LEE Y K, et al. Surface accumulation of low molecular weight dissolved organic matter in surface waters and horizontal off-shelf spreading of nutrients and humic-like fluorescence in the chukchi sea of the arctic ocean [J]. Sci Total Environ, 2018, 639: 624-632. doi: 10.1016/j.scitotenv.2018.05.205 [23] CHEN M, KIM S H, JUNG H J, et al. Dynamics of dissolved organic matter in riverine sediments affected by weir impoundments: Production, benthic flux, and environmental implications [J]. Water Res, 2017, 121: 150-161. doi: 10.1016/j.watres.2017.05.022 [24] CATALA T S, RECHE I, FUENTES-LEMA A, et al. Turnover time of fluorescent dissolved organic matter in the dark global ocean [J]. Nat Commun, 2015, 6: 5986-5994. doi: 10.1038/ncomms6986 [25] SøNDERGAARD M, STEDMON C A, BORCH N H. Fate of terrigenous dissolved organic matter (DOM) in estuaries: Aggregation and bioavailability [J]. Ophelia, 2003, 57(3): 161-176. doi: 10.1080/00785236.2003.10409512 [26] ZHU W Z, YANG G P, ZHANG H H. Photochemical behavior of dissolved and colloidal organic matter in estuarine and oceanic waters [J]. Sci Total Environ, 2017, 607-608: 214-224. doi: 10.1016/j.scitotenv.2017.06.163 [27] CAWLEY K M, BUTLER K D, AIKEN G R, et al. Identifying fluorescent pulp mill effluent in the gulf of maine and its watershed [J]. Mar Pollut Bull, 2012, 64(8): 1678-1687. doi: 10.1016/j.marpolbul.2012.05.040 [28] ZHENG L, SONG Z, MENG P, et al. Seasonal characterization and identification of dissolved organic matter (DOM) in the Pearl River, China [J]. Environmental Science and Pollution Research, 2015, 23(8): 7462-7469. [29] DU Y, ZHANG Y, CHEN F, et al. Photochemical reactivities of dissolved organic matter (DOM) in a sub-alpine lake revealed by EEM-PARAFAC: An insight into the fate of allochthonous DOM in alpine lakes affected by climate change [J]. Sci Total Environ, 2016, 568: 216-225. doi: 10.1016/j.scitotenv.2016.06.036 [30] SONG F H, WU F C, FENG W Y, et al. Depth-dependent variations of dissolved organic matter composition and humification in a plateau lake using fluorescence spectroscopy [J]. Chemosphere, 2019, 225: 507-516. doi: 10.1016/j.chemosphere.2019.03.089 [31] GUO X J, LI Q, JIANG J Y, et al. Investigating spectral characteristics and spatial variability of dissolved organic matter leached from wetland in semi-arid region to differentiate its sources and fate [J]. Clean - Soil, Air, Water, 2014, 42(8): 1076-1082. doi: 10.1002/clen.201300412 [32] TZORTZIOU M, ZERI C, DIMITRIOU E, et al. Colored dissolved organic matter dynamics and anthropogenic influences in a major transboundary river and its coastal wetland [J]. Limnol Oceanogr, 2015, 60(4): 1222-1240. doi: 10.1002/lno.10092 [33] WAGNER S, JAFFE R, CAWLEY K, et al. Associations between the molecular and optical properties of dissolved organic matter in the florida everglades, a model coastal wetland System [J]. Front Chem, 2015(3): 66-80. [34] WANG J J, JIAO Y, RHEW R C, et al. Haloform formation in coastal wetlands along a salinity gradient at South Carolina, United States [J]. Environmental Chemistry, 2016, 13: 745-756. doi: 10.1071/EN15145 [35] CLARK C D, DE BRUYN W J, BRAHM B, et al. Optical properties of chromophoric dissolved organic matter (CDOM) and dissolved organic carbon (DOC) levels in constructed water treatment wetland systems in southern california, USA [J]. Chemosphere, 2020: 247:125906. doi: 10.1016/j.chemosphere.2020.125906 [36] BOWEN J C, CLARK C D, KELLER J K, et al. Optical properties of chromophoric dissolved organic matter (CDOM) in surface and pore waters adjacent to an oil well in a southern california salt marsh [J]. Mar Pollut Bull, 2017, 114(1): 157-168. doi: 10.1016/j.marpolbul.2016.08.071 -



 下载:
下载: